Hoofdstuk 6: Zouten
1
Samenvatting
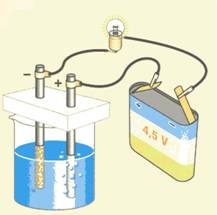
Zouten onderscheiden van andere stoffen (6.1)
Moleculaire stoffen, moleculaire oplossingen en vaste zouten geleiden
geen elektrische stroom. Zoutoplossingen geleiden wel elektrische stroom.
Stoffen die in water opgelost elektrische stroom geleiden, zijn zouten.
Hoe zouten zijn opgebouwd (6.1 en 6.2)
Zouten bestaan uit positieve en negatieve ionen. Ionen zijn
geladen atomen.
In een zout is de totale lading van alle positieve ionen even groot als
de totale lading van alle negatieve ionen. De totale elektrische lading van een
zout is altijd nul.
Bijvoorbeeld: aluminiumchloride bestaat uit Al3+ en Cl- ionen. De positieve lading van Al3+ is 3 x zo groot als de negatieve lading van Cl-. In aluminiumchloride komen daarom 3 x zoveel Cl- ionen voor als Al3+ ionen. Aluminiumchloride
heeft de formule Al3+Cl-3(s)
Vaste zouten geleiden geen stroom: de ionen kunnen niet vrij bewegen.
In gesmolten zouten en in zoutoplossingen kunnen de ionen wel bewegen.
Gesmolten zouten en zoutoplossingen geleiden wel stroom. De positieve ionen
gaan naar de negatieve elektrode. De negatieve ionen gaan naar de positieve
elektrode. Aan de elektroden treden chemische reacties op.
Hoe je zoutformules noteert (6.1)
|
toestand |
formule |
|
vast |
Al3+Cl-3(s) |
|
gesmolten |
Al3+(l) + 3 Cl-(l) |
|
opgelost in water |
Al3+(aq) + 3 Cl-(aq) |
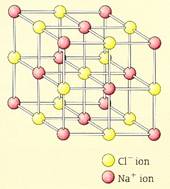
Eigenschappen van zouten (6.1)
· Omdat de positieve en
negatieve ionen van vaste zouten elkaar sterk aantrekken, hebben zouten hoge
smeltpunten. Bij kamertemperatuur zijn zouten vast. De ionen zijn vaak in een
bepaald patroon gerangschikt: een kristalrooster.
· Vaste zouten geleiden geen
elektrische stroom.
De ionen kunnen niet vrij bewegen.
· Zoutoplossingen geleiden
elektrische stroom.
Bij het oplossen wordt de binding tussen de positieve en de negatieve ionen verbroken.
In de oplossing komen de ionen los van elkaar voor. Deze ionen heten vrije
ionen.
· Gesmolten zouten geleiden
elektrische stroom.
Bij die hoge temperatuur blijven de ionen niet meer op een vaste plaats, maar
bewegen langs elkaar.
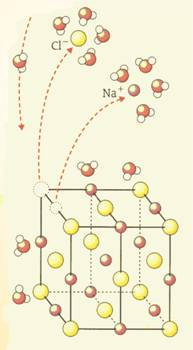
Hoe zouten zich gedragen in oplossing (6.2)
Als een stof oplost in water, dan ontstaat een ionaire oplossing.
Bijvoorbeeld: Cu2+(Cl-)2 --> Cu2+(aq) + 2 Cl-(aq).
IJzerionen hebben de lading 2+ of 3+. Fe2+(Cl-)2 heet ijzer(II)chloride.
Fe3+(Cl-)3 heet ijzer(III)chloride.

Een oplossing van een koperzout is blauw door de Cu2+-ionen.
Een oplossing van een ijzer(III)zout is geelbruin door de Fe3+-ionen.
Formules van zouten opstellen met enkelvoudige en samengestelde ionen (6.3 en 6.4)
Zoutformules zijn verhoudingsformules. Je kunt aan de formule van
een stof zien of de stof een zout is. Bijvoorbeeld Ca2+O2- is een zout, CO2 niet. Aan een formule van een verbinding zonder ionladingen kun je toch
zien dat de stof een zout is. De formule begint met het symbool van een
metaalion.
In een zout komen voor:
- positief geladen metaalionen
- negatief geladen
niet-metaalionen
Bij het opstellen van de formule van een zout moet je het aantal
positieve en negatieve ionen zo kiezen dat de totale elektrische lading nul is.
|
Zoutformules maken |
Voorbeeld: De formule van
magnesiumchloride |
|||
|
1 |
Noteer de naam van het
zout. |
1 |
Naam: |
magnesiumchloride |
|
2 |
Zet de ionen in symbolen. |
2 |
In symbolen: |
Mg2+Cl- |
|
3 |
Zet de verhouding van de
ionen in het zout eronder. De totale lading moet nul zijn. |
3 |
Verhouding: |
1 : 2 |
|
4 |
Noteer de
verhoudingsformule. Zet de ionen tussen haakjes. |
4 |
Verhoudingsformule: |
(Mg2+)1(Cl-)2 |
|
5 |
Laat het cijfer 1 weg. Kijk of de haakjes nodig zijn. |
5 |
Vereenvoudigen: |
Mg2+(Cl-)2 |
|
|
|
|
Haakje bij Mg2+ kan weg. |
|
|
6 |
Schrijf de formule zonder ladingen. |
6 |
Zonder ladingen: |
MgCl2 |
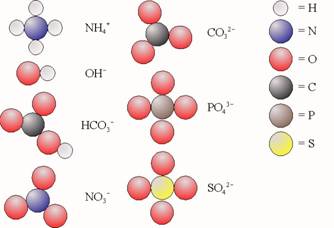
Samengestelde ionen bestaan uit twee of meer atoomsoorten.
De volgende ionen moet je kennen:
|
positieve ionen |
negatieve ionen |
naam van het negatief ion |
||
|
1+ |
K+, Na+, Ag+, NH4+ |
1- |
F-, Cl-, Br-, I- OH-,
NO3-,
HCO3- |
fluoride, chloride, bromide, jodide hydroxide, nitraat, waterstofcarbonaat |
|
2+ |
de meeste metaalionen, bijv. Mg2+, Ca2+ |
2- |
O2-, S2- SO42- CO32- |
oxide, sulfide sulfaat carbonaat |
|
2+ of 3+ |
Fe2+, Fe3+ |
|
|
|
|
3+ |
Al3+ |
3- |
PO43- |
fosfaat |
Oplosbaarheid van zouten (6.5)
Je kunt drie soorten oplosbaarheid onderscheiden: goed, matig en slecht.
- goed oplosbaar; meer dan
10 g per L water
- matig oplosbaar; 1 tot 10
g per L water
- slecht oplosbaar; minder
dan 1 g per L water
Is de oplosbaarheid van een stof heel klein, dan is de stof slecht
oplosbaar. De oplossing bevat weinig vrije ionen.
Een stof die goed oplost, geleidt de stroom goed.
Als een zoutoplossing de elektrische stroom slecht geleidt, dan komen in
de oplossing weinig ionen voor.
De oplosbaarheid van zouten in water vind je in Binas VMBO kgt in
schema 32.
Vergelijkingen met zoutformules (6.1 tot en met 6.5)
|
verandering |
vergelijking |
|
smelten van zout |
Al3+Cl-3(s) --> Al3+(l) + 3 Cl-(l) |
|
stollen van zout |
Al3+(l) + 3 Cl-(l) --> Al3+Cl-3(s) |
|
zout oplossen |
Al3+Cl-3(s) --> Al3+(aq) + 3 Cl-(aq) |
|
zoutoplossing indampen |
Al3+(aq) + 3 Cl-(aq) --> Al3+Cl-3(s) |
antwoorden op de vragen staan onderaan
1Van vier stoffen staat in een oud scheikundeboek:
|
naam
van de stof |
smeltpunt |
kenmerk |
|
houtgeest |
-98 °C |
de
oplossing in water geleidt de elektrische stroom zeer slecht |
|
sylvien |
776 °C |
de
oplossing in water geleidt de elektrische stroom goed |
|
salol |
40 °C |
de
stof lost niet op in water |
|
zoutgeest |
-115 °C |
de
oplossing in water geleidt de elektrische stroom goed |
Welke van deze stoffen zal een zout zijn?
A houtgeest
B
sylvien
C salol
D
zoutgeest
2Is CO2 een moleculaire stof of een
ionaire stof?
En K2O?
CO2 is een K2O is een
A moleculaire stof moleculaire
stof
B
moleculaire
stof ionaire stof
C ionaire stof moleculaire
stof
D
ionaire
stof ionaire stof
3Bernhard maakt een oplossing van kopersulfaat.
a Geef de vergelijking van het oplossen van
kopersulfaat.
b Welke kleur heeft de oplossing?
Hij laat stroom door de oplossing gaan.
c Schets de opstelling die hij daarvoor nodig heeft.
d Welk soort ionen gaat naar de negatieve elektrode?
4De formule van natriumfosfaat is Na3PO4.
Dit betekent dat het aantal
A natriumionen, fosforionen en zuurstofionen in
natriumfosfaat zich verhouden als 1 : 3 : 4
B
natriumionen
en fosfaationen in natriumfosfaat zich verhouden als 1 : 3
C natriumionen en fosfaationen in natriumfosfaat
zich verhouden als 3 : 1
D
natriumionen
en fosfaationen in natriumfosfaat zich verhouden als 3 : 4
5Natriumchromaat heeft de formule Na2CrO4.
Wat is de formule van kaliumchromaat?
A CaCrO4
B Ca2CrO4
C KCrO4
D K2CrO4
6Zeewater is een oplossing van verschillende zouten
in water. In zeewater zijn onder andere natriumchloride en magnesiumchloride
opgelost.
a Geef de formules van de ionen die in elk geval in
zeewater voorkomen.
b Zal zeewater de elektrische stroom geleiden?
Schrijf op waarom je dat denkt.
c Bij het indampen van zeewater ontstaat onder
andere magnesiumchloride.
Geef de vergelijking van dit indampproces.
7a Schrijf de formule met toestandsaanduiding op voor vast
keukenzout.
b Schrijf de formule met toestandsaanduiding op voor
gesmolten ijzer(II)chloride.
c Geef de naam van NH4NO3.
d Geef de formule van lood(IV)sulfide.
e Geef de naam van het zout dat de formule Fe2(SO4)3
heeft.
8Het zout aluminiummanganaat heeft de formule Al2(MnO4)3.
Geef de formule van een manganaation.
Antwoorden
1 Een oplossing van zout in water geleidt de
elektrische stroom. Bovendien hebben zouten een hoog smeltpunt.
Antwoord B is juist.
2 In CO2 komen geen metaalionen voor. CO2
is een moleculaire stof.
In K2O komt het metaalion K+ voor. Daarom is K2O
een ionaire stof.
Antwoord B is juist.
3 a CuSO4(s) --> Cu2+(aq) + SO42-(aq)
b De oplossing is blauw gekleurd door de aanwezigheid van het Cu2+ ion.
c Een eenvoudige schets van deze figuur.

d De negatieve elektrode trekt de positief geladen ionen aan, dus de
Cu2+ ionen.
4 Aan de formule van natriumfosfaat Na3PO4
kun je zien dat er twee soorten ionen zijn. Natriumfosfaat is opgebouwd uit
natriumionen en fosfaationen. De formule met haakjes (Na)3(PO4)
laat dit duidelijk zien. Je ziet dat er 3x zoveel natriumionen als fosfaationen
voorkomen. Het juiste antwoord is C.
5 Natriumionen en kaliumionen hebben dezelfde
lading, namelijk 1 +. In plaats van Na schrijf je K in de formule. Het juiste
antwoord is D.
6 a
Na+,
Mg2+ en Cl-
b In zeewater komen ionen voor. Ionen zijn nodig
voor stroomgeleiding. Zeewater geleidt de elektrische stroom.
c Mg2+(aq) + 2 Cl-(aq)
--> MgCl2(s)
7 a
NaCl(s)
b Fe2+ + 2 Cl-(l)
c ammoniumnitraat
d Het lood(IV)ion is Pb4+. Het sulfide
ion is S2-. De verhouding van de lading is 4 : 2. Dat is 2 :
1. De verhouding van de ionen is omgekeerd, dus 1 : 2.
De formule van lood(IV)sulfide is Pb4+(S2-)2
e In Fe2(SO4)3 is
de lading van het sulfaation 2-. Er zijn 3 sulfaationen. Totaal hebben deze een
lading van 3 x 2- = 6-. De lading in een zout is nul. Daarom moet de lading van de ijzerionen
totaal 6+ zijn. Er zijn 2 ijzerionen. Elk ijzerion heeft een lading van 6+ : 2
= 3+.
De naam van Fe2(SO4)3 is ijzer(III)sulfaat.
8 Het aluminiumion is Al3+. Er zijn 2
aluminiumionen. Aan positieve lading is er dus 2 x 3+ = 6+. De lading in een
zout is nul. Daarom moet de lading van de manganaationen totaal 6- zijn. Er zijn 3 manganaationen. Elk manganaation
heeft een lading van 6- : 3 = 2-.
De formule van een manganaation is MnO42-.