Hoofdstuk 5: Formules
en reactievergelijkingen
Samenvatting
Stoffen bestaan uit moleculen en moleculen uit atomen (5.1)
Stoffen bestaan uit moleculen. Een zuivere stof bestaat uit één soort
moleculen.
Een molecuul is een groepje atomen.
Er zijn ongeveer 100 soorten atomen en wel 20 miljoen soorten moleculen.
Bij chemische reacties hergroeperen de atomen (5.1)
Bij een chemische reactie verdwijnen moleculen van de beginstoffen en
ontstaan nieuwe moleculen van de reactieproducten. De atomen veranderen niet.
De atomen hergroeperen zich: er ontstaan uit de oude groepjes atomen nieuwe
groepjes atomen.
In moleculen van niet ontleedbare stoffen komt maar een atoomsoort
voor.
In moleculen van ontleedbare stoffen zijn meer atoomsoorten
aanwezig.
|
metalen |
niet-metalen |
|
Fe(s) |
H(g) |
|
Au(s) |
O(g) |
|
Cu(s) |
N(g) |
|
Pb(s) |
Cl(g) |
|
Mg(s) |
He(g) |
|
Ag(s) |
Ne(g) |
|
Ca(s) |
Br(l) |
|
Na(s) |
C(s) |
|
K(s) |
I(s) |
Niet ontleedbare stoffen. Moleculen.
Informatie over atoomsoorten (5.1)
In het periodiek systeem vind je informatie over
atoomsoorten. Een periodiek Systeem vind je in Binas
VMBO kgt, schema 31.
Scheiden, smelten en oplossen (5.2)
Bij scheiden, smelten en oplossen veranderen de moleculen niet.
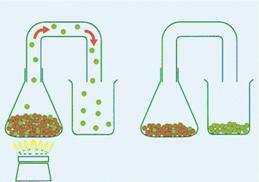
Scheiden van stoffen is ‘sorteren’ van moleculen.
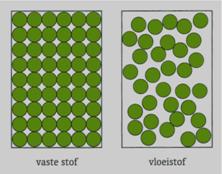
Bij smelten gaan moleculen
langs elkaar bewegen.
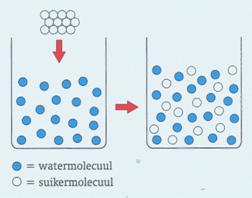
Bij oplossen gaan moleculen van de stof die oplost tussen moleculen
van een vloeistof bewegen.
Ontleden en scheiden (5.2)
Bij chemische reacties veranderen moleculen wel. Bijvoorbeeld bij
ontleden.
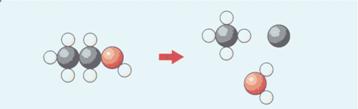
Bij ontleden begin je met één stof, dus ook met één soort
moleculen.
Bij ontleden verdwijnen moleculen en ontstaan nieuwe moleculen.
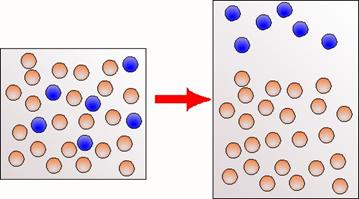
Bij scheiden begin je met meer soorten moleculen, maar deze
moleculen veranderen niet. Na de scheiding heb je de molecuulsoorten apart. De
moleculen zijn onveranderd.
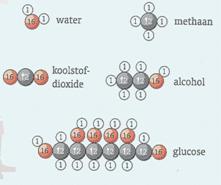
Molecuulformules (5.3)
Met een kommaformule geef je aan welke soorten atomen in een molecuul voorkomen.
In een molecuulformule geef je bovendien aan hoeveel van elke
atoomsoort in een molecuul voorkomen.
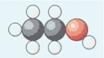
De molecuulformule van alcohol is C2H6O. Een molecuul alcohol bestaat uit 2 atomen C, 6 atomen H en
1 atoom O.
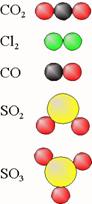
De molecuulformule gebruik je ook als naam voor de stof.
|
niet ontleedbare stoffen |
ontleedbare stoffen |
||
|
waterstof |
H2(g) |
water |
H2O(l) |
|
stikstof |
N2(g) |
ammoniak |
NH3(g) |
|
zuurstof |
O2(g) |
koolstofdioxide |
CO2(g) |
|
fluor |
F2(g) |
zwaveldioxide |
SO2(g) |
|
chloor |
Cl2(g) |
glucose |
C6H12O6(s) |
|
broom |
Br2(g) |
|
|
|
jood |
I2(g) |
|
|
|
ijzer |
Fe(s) |
|
|
|
zwavel |
S(s) |
|
|
In molecuulmodellen en molecuultekeningen zie je hoe atomen aan elkaar
vastzitten.
Namen en molecuulformules (5.3)
Bij het geven van namen gebruik je vaak de voorvoegsels mono, di, tri,
tetra, penta en aan het eind -ide.
Bijvoorbeeld: PBr3(l)
heet fosfortrichloride.
Mono = 1, di = 2, tri = 3, tetra
= 4 en penta = 5.
Je kunt in een reactieschema de namen van de stoffen vervangen door
molecuulformules. Je krijgt dan een reactieschema met molecuulformules.
|
Reactieschema in woorden |
water --> waterstof + zuurstof |
|
reactieschema met
kommaformules |
H,O --> H + O |
|
reactieschema met molecuulmodellen |
|
|
reactieschema met
molecuulformules |
H2O --> H2 + O2 |
Reactievergelijkingen opstellen (5.4)
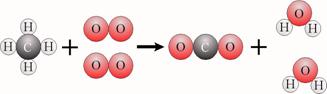
Bij een reactie ontstaan geen atomen en verdwijnen ook geen atomen. Voor
en na de reactie heb je daarom dezelfde soorten atomen en ook dezelfde
aantallen van elke atoomsoort. Er is één verschil: de atomen zijn anders
gegroepeerd.
Alle atomen van de moleculen van de beginstoffen vormen samen de
moleculen van de reactieproducten. Daarom moet je het aantal atomen links en
rechts altijd gelijk maken. Dat heet kloppend maken.
Als je een reactieschema met molecuulformules kloppend maakt, dan krijg
je een reactievergelijking.
|
Een reactievergelijking
opstellen |
Voorbeeld: De verbranding van
waterstof |
||
|
1 |
Schrijf het reactieschema
in woorden op. |
1 |
waterstof + zuurstof --> water |
|
2 |
Maak het reactieschema met
formules. |
2 |
Reactieschema: H2 + O2 --> H2O |
|
3 |
Ga in het reactieschema na hoeveel atomen van elke soort voor en na de reactie voorkomen. |
3 |
Voor de reactie: 2 H atomen en 2 O atomen. Na de reactie: 2 H atomen en 1 O atoom. Met 2 O atomen ontstaan 2 moleculen H2O. Dus 2 moleculen H2O. |
|
4 |
Maak het reactieschema
kloppend. |
4 |
H2 + O2 --> 2 H2O Er ontstaan 2 H2O. Die komen uit 2 H2. 2 H2 + O2 --> 2 H2O |
|
5 |
Controleer of voor en na de
pijl evenveel atomen van elke soort voorkomen. |
5 |
Voor de pijl: 4 x H en 2 x O. Achter de pijl: 4 x H en 2 x O. |
Bij het kloppend maken zorg je ervoor dat het aantal atomen vóór en na de
reactie gelijk is. Kloppend maken doe je door getallen voor de formules te
zetten. Bij het kloppend maken mag je nooit de formules veranderen.
Atoommassa's en molecuulmassa's (5.5)
De massa van een stof wordt bepaald door de massa van alle atomen in de
stof. De massa van een atoom is de atoommassa. In Binas VMBO kgt vind je
in tabel 30 de (relatieve) atoommassa. De molecuulmassa is de som van de
massa’s van alle atomen in een molecuul.
De massa bij reacties (5.5)
Bij reacties verandert de totale massa van de stoffen niet. De totale
massa van de stoffen vóór de reactie is gelijk aan de totale massa van de
stoffen na de reactie.
Als bij een reactie een gas betrokken is, dan kan de massa die je voor en
na de reactie meet, verschillen. Want een gas komt uit de lucht erbij, zoals
zuurstof. Of het gas verdwijnt, bijvoorbeeld koolstofdioxide.
antwoorden op de vragen staan onderaan
1Bekijk de volgende beweringen over deze reactie:
1
Lucht is
een mengsel.
2
Lucht
bestaat uit één soort moleculen.
Welke van deze beweringen is juist?
2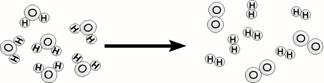
Welk proces geeft de tekening weer?
A water maken
B
water
koken
C water ontleden
D
water verbranden
3Een molecuul chloorethaan bestaat uit 2 atomen C, 5
atomen H en 1 atoom chloor.
Welke formule heeft chloorethaan?
4
Fosfor kan met broom reageren volgens
de vergelijking 2 P(s) + 3 Br2(l) --> 2 PBr3(l).
Bekijk de volgende beweringen over deze reactie:
1
Het
totale aantal atomen vóór de reactie is gelijk aan het totale aantal atomen na
de reactie.
2
Het
totale aantal moleculen vóór de reactie is gelijk aan het totale aantal
moleculen na de reactie.
Welke van deze beweringen is juist?
5Bij de reactie tussen waterstof en chloor ontstaat
waterstofchloride. Waterstofchloride heeft de formule HCl(g).
Wat is de juiste vergelijking van deze reactie?
6Bekijk de reactievergelijking:
4 FeS2(s) + .. O2(g)
-->
2 Fe2O3(s) + 8 SO2(g)
Welke coëfficiënt moet vóór O2 geplaatst worden bij het ‘kloppend’
maken van deze reactievergelijking?
7Je wilt van de stof C2H2 en
van de stof C2H4 een gelijk aantal moleculen volledig
verbranden. Voor welke van deze verbrandingen heb je de meeste
zuurstofmoleculen nodig?
8Bij de verbranding van 1,8 g koolstof ontstaat een
mengsel van 2,8 g koolstofmonooxide en
2,2 g koolstofdioxide. Er is geen koolstof over.
Hoeveel gram zuurstof heeft bij deze verbranding gereageerd met koolstof?
9Voor de verbranding van 700,0 g benzine is 3000 g
zuurstof nodig. Bij deze verbranding ontstaat 950,0 g water.
Bereken hoeveel g verbrandingsproducten er, naast water, zal ontstaan.
10Bij een proef reageert 53 g chloor volledig met
een hoeveelheid chroom. Hierbij ontstaat 79 g chroomchloride.
In welke verhouding hebben chloor en chroom met elkaar gereageerd?
11In een bekerglas zit 15 g natriumcarbonaat. Je
doet er 10 g zoutzuur bij. Er treedt een reactie op. Bij de reactie ontstaan
een natriumchlorideoplossing en koolstofdioxide.
Beredeneer of de massa van het reactiemengsel in het bekerglas kleiner
of groter dan 25 g is, of gelijk is aan 25 g.
Antwoorden
1Lucht is een mengsel van de gassen stikstof,
zuurstof, koolstofdioxide en waterdamp.
Bewering 1 is dus correct.
Lucht is een mengsel van moleculen stikstof, zuurstof, koolstofdioxide en
waterdamp. Lucht bevat dus verschillende soorten moleculen. Bewering 2
is daarom fout.
2Uit watermoleculen ontstaan waterstofmoleculen en
zuurstofmoleculen. De tekening stelt het ontleden van water voor. Het goed antwoord is C.
3C2H5Cl
4Voor de reactie zijn er 6 atomen. Na de reactie
zijn er ook 6 atomen. Dus bewering 1 is juist.
Voor de reactie zijn er 3 moleculen. Na de reactie zijn er 2 moleculen.
Bewering 2 is onjuist.
51 waterstof + chloor --> waterstofchloride
2 Reactieschema:
H2(g) + Cl2(g)--> HCl(g).
3 Voor de reactie: 2 H atomen en 2
Cl atomen.
Na de reactie: 1 H atoom en 1 Cl
atoom.
4 Met 2 H atomen ontstaan 2
moleculen HCl.
Dus 2 moleculen HCl.
H2(g)
+ Cl2(g) -->
2 HCl(g).
5 Voor de pijl: 2 x H en 2 x Cl
Achter de pijl: 2 x H en 2 x Cl
6
4 FeS2(s) + ..
O2(g) --> 2 Fe2O3(s) + 8 SO2(g)
Voor de pijl: 4 x Fe, 8 x S en 2 x .. O
Achter de pijl: 4 x Fe, (6 + 16) x O en 8 x S
Het aantal Fe atomen en het aantal S atomen blijft gelijk. Achter de pijl zijn
er 22 O atomen. Deze 22 O atomen ontstaan uit 22 : 2 =
11 O2 moleculen. Voor O2 moet dus 11 staan.
7Voor elk C atoom is één O2 molecuul
nodig. Voor elke twee H atomen is één O2 molecuul nodig. Voor C2H2
zijn 2 O2 moleculen nodig. Voor C2H4 zijn 3 O2
moleculen nodig.
Voor de verbranding van C2H4 heb je de meeste
zuurstofmoleculen nodig.
8De totale massa van de stoffen na de reactie
(koolstofmonooxide en koolstofdioxide) is
2,8 + 2,2 = 5,0 g. De totale massa van de stoffen voor de reactie = de totale
massa van de stoffen na de reactie. De totale massa van de stoffen voor de
reactie (koolstof en zuurstof) is dus ook 5,0 g. Er is 1,8 g koolstof. De rest
is zuurstof: 5,0 – 1,8 = 2,2 g. Er heeft 2,2 g zuurstof bij de verbranding
gereageerd.
9De totale massa van de stoffen voor de reactie
(benzine en zuurstof) is 700,0 + 3000 = 3700 g. De totale massa van de stoffen
voor de reactie = de totale massa van de stoffen na de reactie.
De totale massa van de stoffen na de reactie is dus ook 3700 g. Hiervan is
950,0 g water. De rest is de massa van de andere verbrandingsproducten 3700 –
950 = 2750 g.
10De totale massa van de stoffen na de reactie
(chroomchloride) is 79 g.
De totale massa van de stoffen voor de reactie = de totale massa van de stoffen
na de reactie.
De totale massa van de stoffen voor de reactie (chroom en chloor) is dus ook 79
g. Er heeft
53 g chloor gereageerd. De massa van chroom is 79 – 53 = 26 g.
De verhouding waarin chloor en chroom met elkaar hebben gereageerd is 53 : 26.
11De totale massa van de stoffen voor de reactie =
de totale massa van de stoffen na de reactie. Daardoor zou de massa van de
stoffen in het bekerglas dus 25 g moeten zijn. Maar … er ontstaat
koolstofdioxide. Dat is een gas. Dit gas verdwijnt uit het glas. Er verdwijnt
materie, dus massa uit het bekerglas. Daardoor wordt de totale massa van de
stoffen in het bekerglas kleiner dan 25 g.
